2022. 10. 21. 12:41ㆍ수학,과학,공학
내 아이가 볼 만한
2020-11-11 23:31:43
post.naver.com/my.nhn?memberNo=41516152
엔트로피란 무엇일까요? | 우주와 시간이 담긴 단 하나의 개념
2020.11.09. 09:019,611 읽음

엔트로피란 무엇일까요? | 우주와 시간을 담은 단 하나의 개념 - 열역학 제2법칙과 엔트로피
우주의 가장 중요한 개념들을 목록으로 작성해야 한다면, 그 목록에는 분명 '엔트로피'가 있습니다.

우주론에서 절대 빠질 수 없는 주제는 바로 '엔트로피'입니다.
그러나 엔트로피를 이해하는 것은
매우 위험해 보입니다.
엔트로피 개념의 새로운 돌파구를 연 과학자
루트비히 볼츠만은 1906년에 목을 맸고,
그의 제자였던 파울 에렌페스트 또한
1933년 스스로 목숨을 끊었습니다.
엔트로피와 관련된 학문인 통계역학의 선구자들은 모두 스스로 목숨을 끊었습니다.
동시에 엔트로피는 목숨을 걸 만한
가치가 있는 개념이기도 합니다.
엔트로피는 우리가 얻는 에너지의 근원이자,
우주의 시작과 종말을
추측할 수 있게 해줍니다.
심지어 우리가 인식하는 '시간'의 본질 또한
엔트로피와 관련이 있습니다.
이제 볼츠만의 묘비에 깊이 새겨진
엔트로피를 이해하기 위해, 200년 전의
산업혁명으로 잠시 돌아가 보겠습니다.

엔트로피를 계산하는 볼츠만 방정식은 그의 묘비에 깊이 각인되어 있습니다.
열역학의 탄생
엔트로피의 개념은 매우 혼란스러웠던
프랑스 혁명기에 탄생했습니다.
엔트로피는 그 개념에 걸맞게 격동과 혼란의 프랑스 혁명기에 태동했습니다.
1793년 1월 14일,
프랑스의 국민공회는 자신들의 왕이었던
루이 16세를 처형할 것을 의결했고,
그 의견에 찬성한 사람들 중에는
공포 정치를 열었던 로베스피에르와
그의 친구이자 학자였던
라자르 카르노가 있었습니다.

공포정치를 펼쳤던 로베스피에르는 익히 알려져있지만, 카르노 가문은 잘 알려져 있지 않습니다. 하지만 카르노 가문은 프랑스의 교육부 장관과 대통령을 배출해낸 명망있는 가문이었습니다.
우리의 이야기는 라자르 카르노의 아들인
사디 카르노에서 시작됩니다.
그가 살았던 당시엔 이미 산업 혁명이 일어나,
열이 일을 할 수 있다는 아이디어가
매우 중요해진 시기였습니다.
그는 이 아이디어를 구현한
증기기관에 큰 관심을 가졌고,
그의 손에서 '열역학'이라는 분야가
본격적으로 꽃피기 시작합니다.

사디 카르노 덕분에 본격적으로 열역학이라는 분야가 꽃피기 시작합니다. 하지만 불행하게도 사디 카르노는 흑사병에 걸려 이른 나이에 세상을 떠납니다.
카르노는 증기기관의 효율을 분석하고,
자신의 이름을 붙인 카르노 순환이라는
이론적인 엔진을 구상합니다.
그리고 열을 모두 일로 전환하는 것에는
명백한 한계가 있다는 사실을 깨달았습니다.

카르노 순환, 또는 카르노 행정이라 불리는 엔진의 작동방식
열은 일로 변환되는 과정에서
필연적으로 마찰이 일어나는데,
한 시스템 안에서 마찰로 인해 발생한 열을
다시 일로 완전히 변환하는 것은 불가능하다고
카르노는 생각했습니다.

카르노는 열기관의 한계를 명확히 규정합니다.
카르노의 아이디어는
루돌프 클라우지우스에게 전해졌고,
클라우지우스는 카르노에게 영감을 받아
"열은 차가운 쪽에서 더운 쪽으로
자발적으로 흐르지 않는다"고 선언합니다.
이것이 열역학 제2법칙의 초기 버전입니다.

열역학 제2법칙의 클라우지우스 버전
이 내용을 좀 더 잘 이해하기 위해
가역성과 비가역성에 관해
이야기해보겠습니다.
가역성과 비가역성

뜨거운 물과 차가운 물을 한 곳에 담으면,
뜨거운 물의 열은 차가운 물로 이동해
결국 미지근한 평형 상태에 도달합니다.
만약 이 장면을 녹화해서 거꾸로 재생해도
아무런 문제가 없다면 우린 이것을
'가역적'이라고 말합니다.
그러나 거꾸로 재생되는 영상에서
우리는 즉각 이상함을 눈치챌 것입니다.
똑같은 온도의 물에서 열을 추출해
뜨거운 물과 찬 물을 만들어낸다는 개념은
우리의 현실과 어긋나기 때문입니다.
따라서 열은 비가역적입니다.

차가운 물과 뜨거운 물은 결국 섞여 미지근하게 되지만, 이 반대의 과정은 일어나지 않습니다. 따라서 열은 비가역적입니다.
클라우지우스의 엔트로피
클라우지우스는 이처럼
열이 한 방향으로만 흐르는 상황을 측정하고
계산할 수 있는 개념을 만들고,
여기에 '변화'를 뜻하는 고대 그리스어인
'엔트로피'라는 이름을 붙였습니다.

클라우지우스의 엔트로피 식
엔트로피는 흔히 대문자 S로 표시하고,
열 Q를 온도 T로 나눈 값으로 제시됩니다.
이렇게 정리된 엔트로피가
어떤 특성을 보여주는지 알아보기 위해
하나의 예시를 들어보겠습니다.
여기 온도가 Th인 뜨거운 돌과,
Tc의 차가운 온도를 가지는 물이 있습니다.

뜨거운 돌을 차가운 물에 빠뜨리는 엔트로피 실험
이제 돌을 물에 넣어 ΔQ만큼의 열이
돌에서 물로 전달되는 경우를 보겠습니다.
클라우지우스의 엔트로피 식에 의해,
돌의 엔트로피는 ΔQ/Th만큼 감소하고,
물의 엔트로피는 ΔQ/Tc만큼 증가합니다.

돌과 물의 엔트로피 변화
따라서 전체 엔트로피의 변화량은
아래의 식과 같으며,
차가운 물의 온도인 Tc는
뜨거운 돌의 온도인 Th보다 작으므로,
그 역수의 차이는 0보다 클 수밖에 없습니다.
즉 엔트로피의 변화량 ΔS는
언제나 양수입니다.
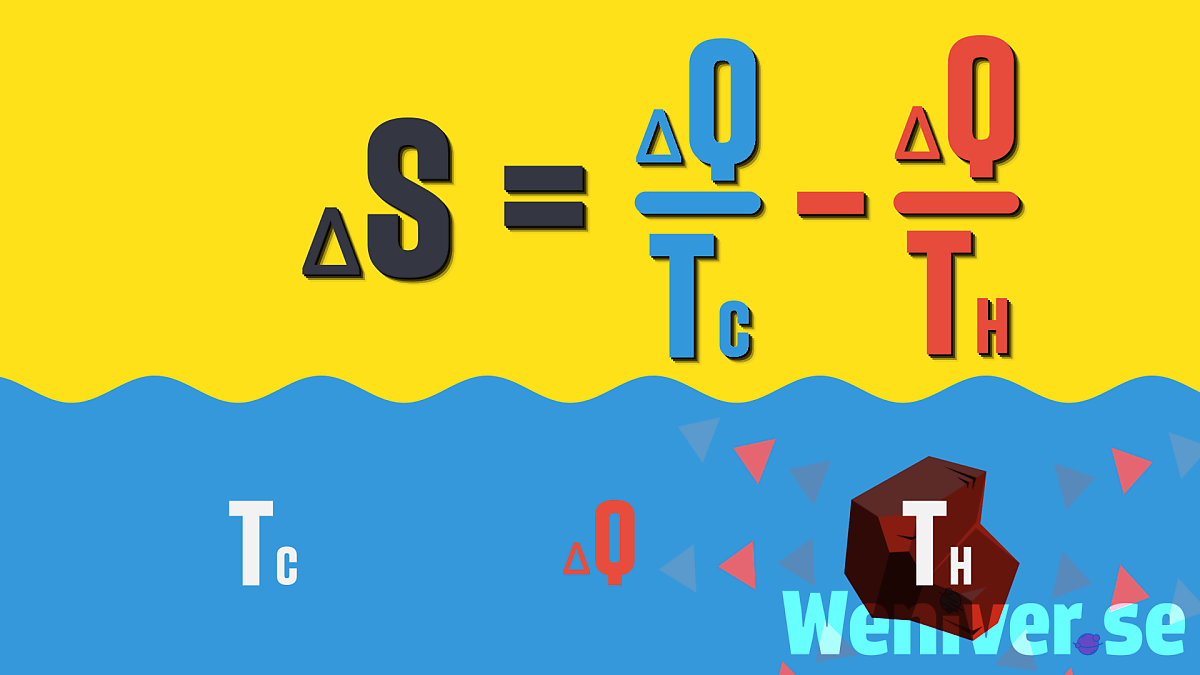
엔트로피 변화량은 물과 돌의 엔트로피를 합치면 됩니다.

식을 정리하면 위와 같으며, 언제나 양수일 수밖에 없습니다.
이제 우리는 열역학 제2법칙을
"엔트로피는 항상 증가한다"고
더 세련되게 말할 수 있습니다.
물론 가역적 과정에서 엔트로피는
변하지 않으므로 등호가 붙어야 합니다.
하지만 현실 세계에서
완전하게 가역적인 과정은 없기 때문에
우주 전체의 엔트로피는 항상 증가하고
있다고 봐도 무방합니다.

열역학 제2법칙의 세련된 표현 : 엔트로피는 항상 증가한다.
이제 천재 과학자 볼츠만이 나타날 차례입니다.
볼츠만의 엔트로피
열과 온도, 엔트로피와 같은 물리량들은
기체의 일반적 특징을 설명하는
매우 편리한 도구입니다.

열과 온도, 엔트로피와 같은 거시적 물리량들은 매우 편리하며, 우리의 직관에 큰 문제가 없습니다.
우리는 갇혀있는 기체를
단순히 거시적인 한 덩어리로 간주해
손쉽게 기체의 평균 운동 에너지를 구합니다.
이것은 어려울 게 전혀 없습니다.
기체의 평균 운동 에너지는 단순히
온도에 비례한다는 것을 알고 있으니까요.

기체의 평균 운동에너지는 온도를 측정함으로써 손쉽게 구할 수 있습니다.
하지만 기체 내부의 사정은 훨씬 복잡합니다.
사실 기체 속에는 수많은 분자들이
제각각의 에너지를 가지고 서로 충돌하며
에너지를 교환하기 때문입니다.
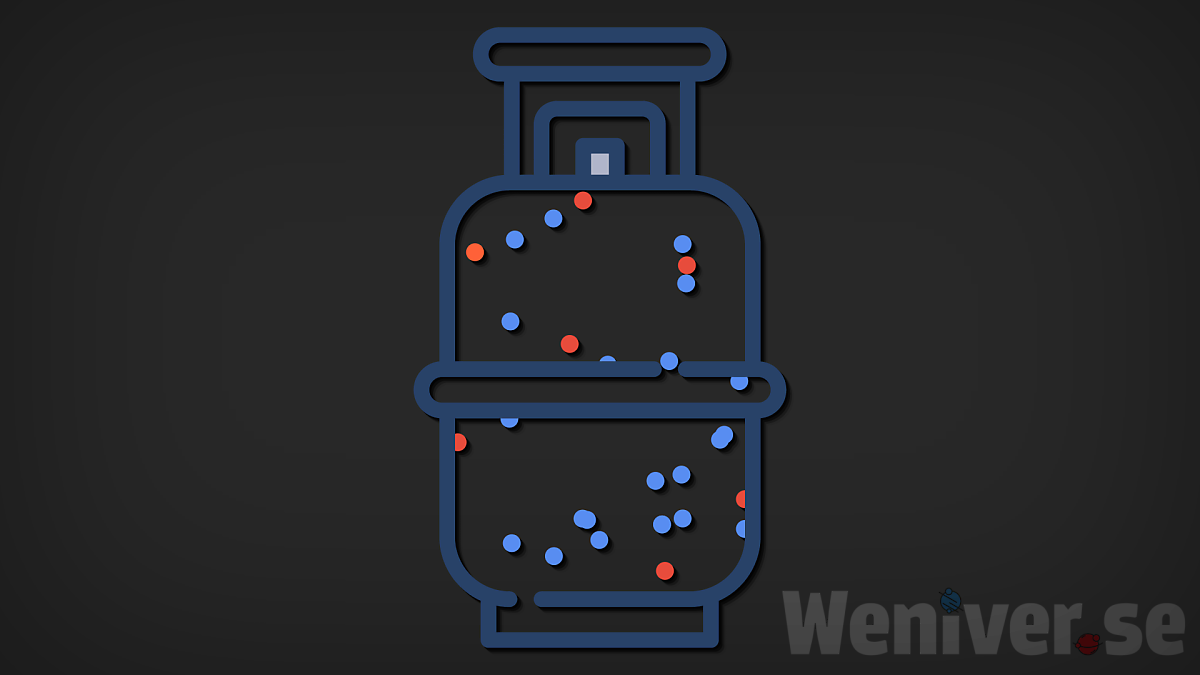
하지만 기체 내부의 분자들은 제각각의 운동에너지를 가지고 있습니다.
볼츠만은 이를 간파했고,
엔트로피라는 거시 상태의 특징은
사실 미시 상태들의 통계적 특징으로 인해
나타나는 것이라는
매우 독특한 해석을 내놓았습니다.

엔트로피에 관한 볼츠만의 해석
그리고 엔트로피를 계산하는
새로운 방정식을 제시합니다.

볼츠만의 새로운 엔트로피 공식 'S=klogₑW'는 기체의 통계적 특징으로부터 도출됩니다.
당시에 이 생각은 매우 도발적이었습니다.
볼츠만의 주장은 물질이 매우 작은 입자들인
원자로 이루어져 있다는 것을
전제로 하기 때문입니다.

볼츠만의 설명은 기체들이 매우 작은 입자들로 이루어져 있다는 것을 전제로 합니다.
볼츠만이 살았던 시대의 학자들 대다수는
원자론에 회의를 가지고 있었습니다.
따라서 볼츠만의 엔트로피 해석은
천대받을 수밖에 없었습니다.

그의 주장은 비주류 의견이었기에, 많은 비난을 받았습니다.
그러나 브라운 운동이라 불렸던
꽃가루의 움직임을 아인슈타인이 원자론적으로
해석하는데 성공하며 전환점을 맞습니다.

당시 작은 꽃가루의 미세 진동을 규명하는 것은 매우 중요한 과제였습니다. 그리고 아인슈타인은 이를 원자론과 통계역학을 동원해 해석하는데 성공합니다.
아인슈타인이 브라운 운동에 관한 논문을
상세하게 내놓은 것은 1908년이었습니다.
하지만 볼츠만은 이보다 2년 전인
1906년에 스스로 목숨을 끊은 뒤였죠.

브라운 운동의 해석은 원자론의 강력한 증거로 여겨집니다. 하지만 볼츠만은 이미 2년 전에 목숨을 끊었습니다.
볼츠만이 남긴 해석 덕분에,
엔트로피는 우리에게 더 직관적이고
인상적인 개념으로 변화합니다.
이제 엔트로피라는 단어를
'무질서의 정도'로
바꿔 말할 수 있기 때문입니다.

엔트로피는 '무질서도'라는 개념으로 재해석됩니다.
무질서도의 계산
1. 분리된 카드의 엔트로피
볼츠만 공식은 클라우지우스의 개념보다
훨씬 직관적입니다.
세 개의 숫자가 적혀 있는 빨간색 카드와
파란색 카드를 갖고 있다고 생각해보겠습니다.

파란색과 빨간색 카드로 볼츠만의 엔트로피를 설명해보겠습니다.
각 색깔의 카드가 가질 수 있는 배열은
3!로 6가지입니다.
볼츠만 공식의 W가 바로 이러한
미시 상태 배열의 가짓수를 의미합니다.

각 색깔의 카드가 가질 수 있는 배열의 수는 6가지입니다.

볼츠만 공식의 W가 바로 이런 미시상태 배열의 가짓수입니다.
볼츠만 상수로 불리는 k를 무시한다면,
빨간색 카드와 파란색 카드의 무질서도,
즉 엔트로피는 각각 logₑ6입니다.
따라서 전체 시스템의 엔트로피는
로그의 덧셈 연산에 의해 logₑ36이며,
이 값은 대략 3.58입니다.

볼츠만 상수라 불리는 k를 무시하면 각각의 엔트로피는 logₑ6으로 표현됩니다.

로그의 연산법칙에 의해 logₑ6 + logₑ6은 logₑ36입니다.

이 값은 대략 3.58이 됩니다.
2. 합쳐진 카드의 엔트로피
하지만 두 종류의 카드를
한 곳에 섞으면 어떻게 될까요?

이번에는 두 종류의 카드를 합쳐보겠습니다.
카드는 총 6장이 되므로,
카드를 배열하는 경우의 수는 6!이며
계산해보면 720가지가 됩니다.
그러므로 이 상태의 엔트로피는
logₑ720이고, 이는 대략 6.58입니다.

카드 배열의 가짓수는 720이므로, 엔트로피는 logₑ720입니다.

이 값은 6.58입니다.
3. 엔트로피를 비교하기
두 상태의 엔트로피를 비교해보면,
카드가 섞여 있을 때의 엔트로피가 더 큽니다.

분리된 시스템과 합쳐진 시스템의 엔트로피 차이
빨간색과 파란색의 카드는 두 종류의
기체가 담긴 상자와 마찬가지입니다.
기체가 분리된 상태일 때
전체 시스템의 엔트로피는 3.58이지만,
만약 상자의 벽을 치워
기체들을 상호작용하게 만들면
전체 시스템의 엔트로피는 6.58로 치솟습니다.
기체는 분리되어 있을 때보다
섞여 있을 때의 엔트로피가 훨씬 더 큽니다.
따라서 두 종류의 기체는 완전히 균질되어
무질서하게 뒤섞여버립니다.

분리된 상태보다 합쳐진 상태의 엔트로피가 더 크므로, 분자들은 뒤섞입니다.
따라서 열역학 제2법칙은
"우주의 무질서는 꾸준히 증가한다"는
문장으로도 바꿀 수 있습니다.

볼츠만의 해석은 엔트로피를 새롭게 규정하도록 돕습니다.
그리고 이 해석은
우리를 새로운 영역으로 인도합니다.
그것은 바로 시간의 화살과 우주론입니다.

엔트로피의 재해석은 우리를 새로운 영역으로 인도합니다.
시간의 화살
두 종류의 기체가 마구 섞여있는 상자 앞에서
끈기 있게 기다리면
두 기체가 다시 분리되는 순간이 올까요?
이는 무질서한 입자가
질서있게 배열된다는 의미이며,
깨진 파편들이 합쳐져
다시 유리병이 되는 것과 마찬가지입니다.
만약 이런 일이 벌어진다면
우리는 마치 시간을 거꾸로 되돌리는 듯한
느낌을 받을 것입니다.

입자들은 무질서에서 질서로 되돌아갈 수 있을까요?
분명히 미시적인 분자 하나하나는
자유롭게 운동을 할 수 있습니다.
즉, 대부분의 운동은 가역적입니다.
하지만 거시적 과정에서
무질서가 질서로 뒤집히는 반전은
기대할 수 없습니다.
이것이 바로 엔트로피의 비가역성입니다.

분자 하나는 자유로운 운동을 합니다. 따라서 개별적 분자는 가역적입니다.

그러나 거시적 과정에서 무질서가 질서로 변하는 과정은 존재할 수 없습니다. 따라서 거시적 시스템은 비가역적입니다.
결국 시간의 흐름을 느끼는 것은
엔트로피의 증가를 목격하는 것에 불과합니다.
이렇듯 시간은
우리에게 희미하게 다가오는 개념에 불과하며,
볼츠만은 시간의 흐름에
본질적인 것이 없다고 생각했습니다.

비가역적 특성을 가지는 물리량은 엔트로피밖에 없습니다. 따라서 시간의 일방향성은 엔트로피에 기인합니다.
이제 엔트로피의 핵심으로 들어갈 차례입니다.
대체 왜 엔트로피는 항상 증가하는 것일까요?
그것은 초기 우주의
특별한 상태와 관련이 있습니다.
엔트로피와 우주론
엔트로피와 관련된 우주론을 이야기하려면
‘특별'하다는 단어에 관해
잠시 생각해봐야 합니다.

특별하다는 것은 무엇일까요?
사실 '특별'하다는 단어는 상대적 개념입니다.
만약 여러 장의 알파벳 카드를 바닥에 던져
셰익스피어의 햄릿이 말한 대사가 나왔다면,
우리는 이러한 카드 배열을
매우 특별하다고 생각할 것입니다.
그러나 다시 카드를 던져 이런 배열이
또 나올 것을 기대하지 않는 것이 좋습니다.

카드를 던져 햄릿의 명대사가 나온다면?
카드를 다시 던졌을 때,
아래의 배열이 나오면 어떨까요?
이 배열은 무작위로 배열된 것처럼 보입니다.

카드를 던져 이런 배열이 나온다면, 영어권 사람들은 무작위로 배열된 것으로 생각할 것입니다.
하지만 이 배열은 햄릿이 말한 대사를
한국어 발음으로 옮겨 적은 것입니다.

그러나 이를 발음으로 옮겨보면, 한국어로 해석됩니다.
아래의 배열은 어떨까요?
이것은 햄릿의 문장을
독일어로 번역한 것입니다.
이처럼 모국어가 아닌 문장은
무작위로 배열된 것처럼 느껴집니다.
결국 우리가 느끼는 특별함은 상대적입니다.

이 배열은 햄릿의 독일어 번역입니다. 이처럼 특별함은 상대적입니다.
이와 같은 논리로
만약 초창기 우주가 특별한 상태였다면,
즉 초기의 우주가
극도로 질서정연했다는 가정을 세운다면
확률적인 논리로 인해 엔트로피는
미래로 가면서 증가할 수밖에 없습니다.

엔트로피가 증가하는 이유는 초기의 우주가 매우 질서정연했기 때문이라는 논리적 귀결로 이어집니다.
다시 말해,
엔트로피가 항상 증가할 수밖에 없는 이유는
초기 우주가 극도로 질서정연했기 때문입니다.
일련의 과학적 증거들로 인해,
초기 우주의 엔트로피가 매우 낮았다가
시간이 지나면서 증가해왔다는 것은
사실로 보입니다.
우리의 우주는 점차 무질서해져
결국 우주 전체의 온도가 어디에서나 같아지는
열역학적 사망에 이르게 될지도 모릅니다.
이 모든 것이 엔트로피 때문입니다.

우주의 엔트로피는 점점 증가해, 열역학적 사망에 이를 수 있습니다. 이러한 추측의 근거는 엔트로피가 언제나 증가한다는 사실 때문입니다.
준비한 내용은 여기까지입니다.
내용이 유익했다면 구독과 좋아요로
응원해주세요 :)
'수학,과학,공학' 카테고리의 다른 글
| 1129. 베르누이 원리, 비행기가 뒤집혀 나는 건 어떻게 설명? (0) | 2022.10.21 |
|---|---|
| 1125. 아인슈타인, 열역학, 블랙홀 (0) | 2022.10.21 |
| 1108. 블랙홀 존재 입증한 '특이점 정리' 미래 물리학을 예견하다 (0) | 2022.10.21 |
| 1105. 콜라겐 먹으면 피부에 좋다, 사실일까? (0) | 2022.10.20 |
| 1103. 존 카맥, 양자역학 그리고 매트릭스 (0) | 2022.10.20 |